martes, 29 de marzo de 2022
viernes, 25 de marzo de 2022
martes, 22 de marzo de 2022
martes, 22 de febrero de 2022
martes, 1 de febrero de 2022
jueves, 27 de enero de 2022
viernes, 7 de enero de 2022
jueves, 4 de junio de 2020
jueves, 28 de mayo de 2020
TÉCNICAS DE HIGIENE ORAL EN ANCIANOS CON DISFÁGIA
TÉCNICAS DE HIGIENE ORAL EN ANCIANOS CON DISFÁGIA JORNADA TÉCNICA DE CUIDADOS A LA DISFAGIA - PDF Descargar libre:
TÉCNICAS DE HIGIENE ORAL EN ANCIANOS CON DISFÁGIA JORNADA TÉCNICA DE
CUIDADOS A LA DISFAGIA PLACA BACTERIANA Depósitos bacterianos acumulados
en la cavidad oral La acumulación de placa se considera causa
domingo, 2 de junio de 2019
lunes, 4 de junio de 2018
miércoles, 16 de mayo de 2018
domingo, 23 de octubre de 2016
sábado, 24 de septiembre de 2016
sábado, 30 de abril de 2016
miércoles, 9 de marzo de 2016
martes, 16 de febrero de 2016
Pulpectomía, Pulpotomía
¿Qué es una pulpotomía? ¿Y una pulpectomía?
Es muy frecuente que se visite al
odontopediatra y le comente que su hijo necesita una o varias
pulpotomia o pulpectomía en molares temporales.
El nervio de los dientes se llama
también pulpa. Tanto la pulpotomía como la pulpectomía son tratamientos
exclusivos de dientes de leche, no se realizan en dientes definitivos.
Pulpotomía se realiza en dientes
temporales, y consiste en eliminar parte de la pulpa o nervio del
diente, se coloca un material junto con el nervio remanente y se realiza
la reconstrucción de la pieza.
Pulpectomía es la eliminación de 2/3
partes de la pulpa o nervio del diente temporal. Se procede a rellenarlo
con un material que se reabsorbe (elimina) a la vez que el diente para
evitar que interfiera en el defintivo, y se restaura definitivamente.
¿Cuándo hay que realizarlas?
Cuando la caries ha llegado tan profunda que afecta al nervio o pulpa del diente.
¿Es frecuente que haya que hacerlas?
Para poder confirmar
que hay que hacer cualquiera de los dos tratamientos hay que hacer una
radiografía de la pieza/as. Cuando se ve la profundidad de la caries y
la afectación de las raíces es cuando se puede plantear cuál es el mejor
tratamiento.
¿Es doloroso o no?
NO tiene por qué, todas se realizan con anestesia.
¿Se puede hacer en una sesión?
Sí, junto con la restauración final, dependerá del estado del molar en el momento de hacerlo.
¿Qué finalidad tiene hacer una pulpotomía o una pulpectomía?
La finalidad de la pulpotomía es
mantener la pulpa de las raíces sana, sin signos clínicos ni
radiológicos de afectación como pueden ser: dolor, sensibilidad,
inflamación y la presencia de reabsorciones radiculares. No debe
existir lesión en el germen del diente permanente.
Tratar el nervio de una muela de leche NO interfiere en absoluto con la futura muela definitiva ya que cada una tiene su nervio.
Si quieren saber más sobre estos dos tratamientos, les redirijo a la página de la sociedad española de odontopediatría .
sábado, 6 de febrero de 2016
Haz una pregunta » El flúor y la prevención de la caries dental
En octubre de 2008, la Agencia Francesa de Seguridad Sanitaria de los Productos para la Salud (AFSSAPS) publicó una guía para el uso del flúor en la prevención de la caries dental en menores de 18 años.
Entre los diversos tratamientos preventivos de la caries, el flúor ha sido siempre considerado como un elemento indispensable para mantener el buen estado de la flora bucodental .

El riesgo de caries
Riesgos fisiológicos o comportamentales
- No respetar las reglas de higiene alimentaria: comer o beber soda entre comidas, ingerir alimentos después de la cena o en la noche.
- Dormir con un biberón que contenga alguna sustancia que no sea agua pura.
- Cepillarse mal los dientes o no cepillarse.
- Antecedentes de caries en el niño o en los padres.
Riesgos externos
- Bajo nivel socioeconómico de la familia.
- Enfermedad o discapacidad que impida al niño un cepillado adecuado.
- Uso de aparatos de ortodoncia.
- Consumo prolongado de medicamentos azucarados.
Acción del flúor sobre el tejido dentario
Antes de la erupción dentaria
- Los fluoruros actúan principalmente sobre:
- El metabolismo celular de los ameloblastos (responsables de la formación del esmalte).
- El metabolismo celular de los odontoblastos (encargados de producir la dentina).
Después de la erupción dentaria
- El esmalte está siempre expuesto a la saliva, a los alimentos y a la placa bacteriana. En estos casos los fluoruros:
- Limitan la desmineralización y favorecen la remineralización.
- Hacen más lento el metabolismo de las bacterias que causan la caries.
Fuentes de flúor
- El agua para consumo humano
- El agua de grifo, cantidad máxima autorizada: 1,5 mg/l,
- El agua mineral natural en botella:
- Límite fijado: 0,5mg/l,
- Recomendada para preparar los alimentos del lactante.
- El agua de manantial que contiene cantidades variables de flúor.
- Los alimentos
- Sal fluorada que es muy utilizada en los comedores.
- Pescado de mar.
- Té.
- Los productos para la salud: medicamentos, productos para la higiene y productos sanitarios que son administrados por:
- Vía tópica:
- Con bajo contenido de flúor: <150mg/100g: productos para la higiene como los dentífricos y los enjuagues bucales (de venta libre).
- Con alto contenido de flúor: > 150mg/100g: dentífricos, geles y barnices fluorados cuya comercialización depende de una Autorización de Puesta en el Mercado (APM).
- Productos sanitarios de uso estrictamente profesional que son empleados para prevenir alguna afección del tejido dentario o para reconstituirlo.
- Vía sistémica: comprimidos, gotas.
- Vía tópica:
Los riesgos de la sobredosis de flúor
- Fluorosis dental
- Debido a una sobredosis de flúor durante el período de mineralización.
- Provoca que el tejido dentario se vuelva fluorótico y poroso.
- Para evitar la fluorosis, no se debe sobrepasar la siguiente dosis: 0.05mg/peso corporal en kg en un día.
- Fluorosis del esqueleto, provocada por la absorción de dosis muy altas (10-40 mg en un día).
Flúor y medidas preventivas de la caries dental
- Cepillarse los dientes todos los días con un dentífrico que se acondicione a la edad.
- La limpieza bucal de los niños de 0 a 6 años debe ser asistida por un adulto.
- Verificar la calidad.
- Asegurarse de la duración del cepillado.
- Controlar la cantidad de dentífrico que se utiliza.
- Administración de productos fluorados en el niño con alto riesgo de caries:
- gotas.
- comprimidos.
- barnices y geles fluorados.
- enjuagues bucales.
lunes, 18 de enero de 2016
Dientes sensibles, sensibilidad dentinaria
Sensibilidad dentinaria
“Hiperestesia dentinaria” ¿Te duelen los dientes como una corriente eléctrica, cuando bebes algo frío, o al cepillarte?. Puede que tengas Sensibilidad Dentinaria. Un problema que afecta a 1 de cada 3 adultos.¿Qué es la Sensibilidad Dentinaria o Hiperestesia?
Hiper: mucho más, más que. Stesia: sentir dolor, sensación, tacto. An-stesia : no sentir, no doler, no percibir.Ya sé, ésto te aburre, pero el saber te hace menos burro. Sigue leyendoEs una sensación dolorosa, como un calambrazo, una corriente eléctrica, que se percibe en los dientes, y que dura de dos a cinco segundos. Si dura más de cinco segundos, no es sensibilidad dentinaria, y por lo tanto cambia el tratamiento.
El dolor no es espontáneo, no surge de repente, porque sí. El dolor es provocado, viene y se va en cinco segundos o menos. Pero es intenso. Es agudo. Te sorprende de golpe.
Es provocado al comer algo dulce y pegajoso,(chocolate,caramelo blando) al beber o comer algo frío y no tan frío, al cepillarse, al enjuagarse, al morder un helado, al beber algo muy caliente. Incluso al respirar por la boca en invierno. Pero se va en cuanto quitamos el estímulo. No se queda.
¿Porqué duelen los dientes?
Los dientes no son de piedra. Aunque algunos los tratan como si lo fueran. El diente es un órgano vivo, integrado por la pulpa dental y la dentina que la cubre. Formando un Sistema Pulpo-Dentinario. La Pulpa contiene terminaciones nerviosas muy sensibles, pero sólo al dolor. Los dientes no sienten frío ni calor. Sólo saben de dolor y presión, nada más.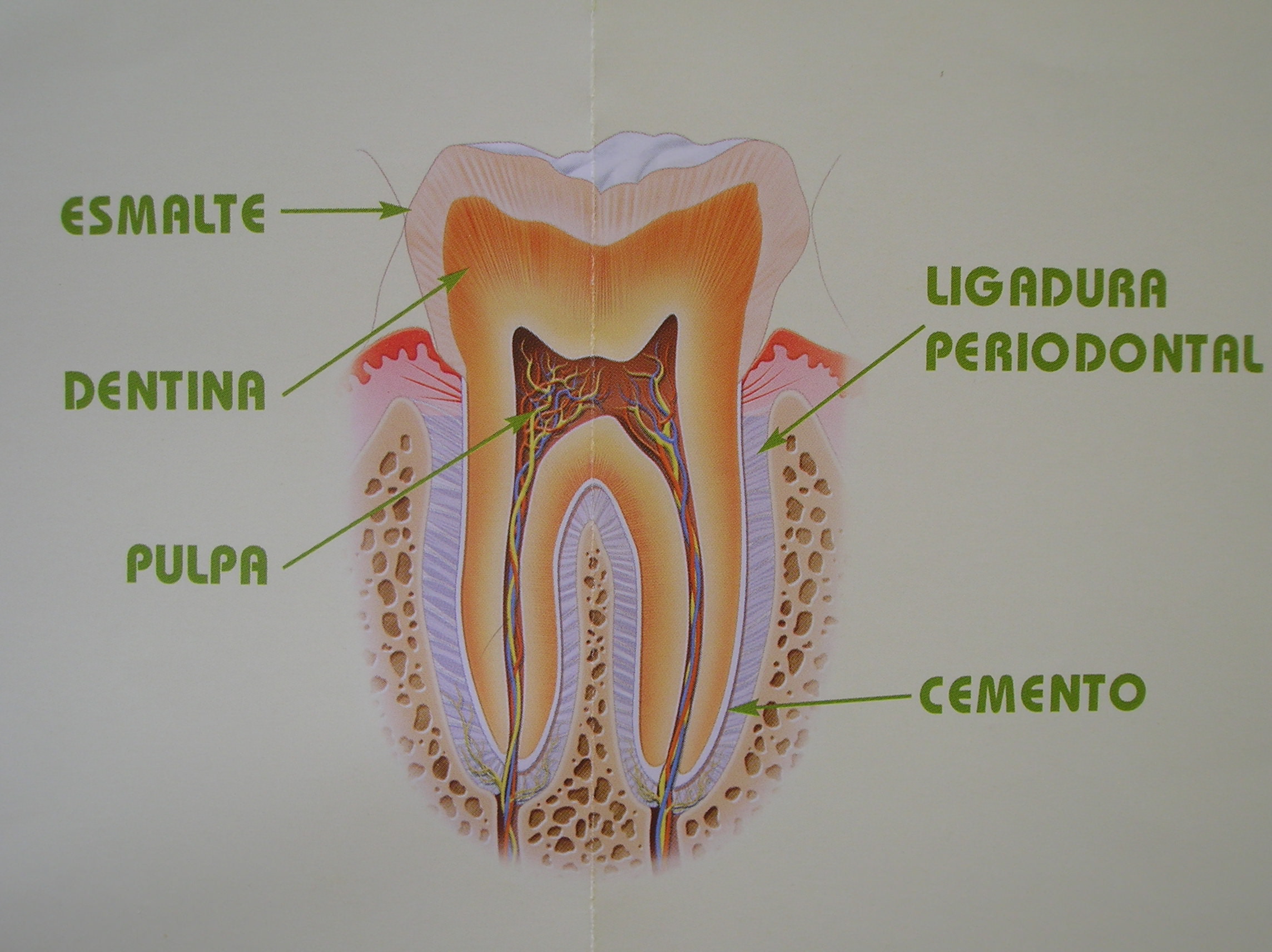
Dibujo de la estructura interna de un primer molar inferior

Foto de un auténtico molar superior humano, cortado longitudinalmente, para que veas la realidad por dentro.
Lo que duele, no es el “esmalte”, sino la “dentina”, que transmite el estímulo a la pulpa dental (el famoso “nervio” que se “mata” cuando se hace una endodoncia, y a veces no muere, y hay que volver a matarlo. Es duro de pelar. Esto es broma)
La dentina está recubierta por esmalte en toda la corona .La corona es la parte del diente que tú puedes ver en tu boca. Todo lo que ves de un diente en tu boca es esmalte de la corona. Pero si gastamos el esmalte, debajo encontramos la dentina. Y ésta dentina, está atravesada por miles de conductillos microscópicos que alojan terminaciones nerviosas que llegan a la pulpa ( la que duele). Hay 65.000 conductillos dentinarios por milímetro cuadrado de superficie dental.

Conductillos
dentinarios: Atravesados por las prolongaciones nerviosas de la pulpa
dental. Microfotografía coloreada, para apreciar el submundo de tu
diente; la dentina.

Dibujo esquemático de un molar inferior.

Foto
Canino superior. La RAÍZ está recubierta por CEMENTO, 0.1 mm en el
cuello y hasta 2 mm. en la punta de la raíz.(ÁPICE).La CORONA está
recubierta por el ESMALTE

Foto corte longitudinal del mismo diente. Estructura interna.Pincha sobre las fotos para mayor aumento.

Foto
del mismo diente. Fue coloreado para ver: RAIZ, CORONA. La cintura es
el CUELLO. En el centro, en rojo, la PULPA DENTAL. Rodeando toda la
pulpa está la DENTINA.

1º
molar superior humano con 3 raíces.Corte longitudinal, puede apreciarse
en la corona, la estructura cristalina del ESMALTE, que cubre el diente
formando 2 cúspides puntiagudas.

El
mismo molar coloreado para ver: 3 Raíces. En la raíz de la izquierda,
se ve la longitud completa de un conducto que sale de la Cámara
Pulpar-en el centro en rojo-. La cámara tiene dos puntas llamadas
“cuernos pulpares”

Otro
molar superior. En la raíz de la derecha se aprecia la longitud
completa del conducto radicular,en rojo fuerte. Todo lo demás que se ve
en rojo es DENTINA. En la corona, abajo, lo blanco, es ESMALTE
Compréndase la dificultad que tiene el Dentista para limpiar estos 3
conductos, siendo delgados,calcificados y curvos,cuando tiene que hacer
una Endodoncia.
Con el tiempo las encías se van encogiendo un poco mas. El cuello del diente queda al descubierto. El esmalte se termina. Empieza a aparecer 0.5 o 0.7 mm de raíz al descubierto. Es una zona sin esmalte, en el cuello del diente, al ras de la encía. Esa zona es el límite entre “corona dental” y “raíz”. Al límite, se le llama “cuello”.
En el cuello, no hay esmalte. En la raíz no hay esmalte. La raíz está rodeada de una estructura llamada “cemento “, que mide de 0,5 mm. a micrómetros ( 1 milésima de mm.) de espesor. Cuando los cuellos quedan al descubierto, aparece el “cemento” y si este se gasta, aparece la “dentina”. La dentina es la que duele. Por eso se llama sensibilidad dentinaria, por la dentina, no por el diente.
Los conductillos dentinarios quedan al descubierto y su boca de salida al exterior está abierta. Los estímulos dolorosos se transmiten directamente al centro del diente, a la pulpa dental. Cada conductillo dentinario mide una media de 0.5 a 2 micrómetros de diámetro. Un micrómetro o micrón es la milésima parte de un milímetro.

Cuellos
con desgaste. Cuanto más sobresale el diente, más lo gastas al cepillar
en horizontal. Hace efecto serrucho. Hay que cepillar en vertical para
minimizar el daño.
¿Porqué se gastan los cuellos dentarios?
Porqué se retraen las encías, es tema de otro capítulo. Pero ¿porqué se gastan los cuellos? es muy importante saberlo, para curar el problema de la sensibilidad dentinaria y sobre todo para saber cómo prevenirlo, que es lo realmente importante.Se gastan por usar incorrectas técnicas de cepillado
La técnica es sencillísima, tanto que todos creen que saben cepillarse. Pero la realidad es que nadie nace sabiendo. Hay técnicas correctas y técnicas inútiles e incluso perjudiciales. La técnica se aprende. La técnica se enseña. La técnica mejora con la práctica. La técnica requiere querer aprender y que tu dentista te la quiera enseñar. Pero enseñar en forma práctica, demostrando cómo se hace, con el cepillo puesto en tu boca, no con un fantoma o con un dibujo. Enseñar implica: explicar, mostrar, demostrar, practicar, evaluar.Se gastan por usar cepillos dentales de dudosa calidad
Están los que piensan -como es lógico- que el cepillo duro limpia mejor. Pues no. El cepillo tiene que ser suave y cambiarlo cada 2 o 3 meses. …¡ ” es que el suave no me dura nada, se me gasta enseguida”!… Tiene que durar 2 meses. Si dura 15 o 20 días, es que estás cepillando demasiado fuerte y te gastas los dientes, sin conseguir tener la boca realmente limpia. Es maña, no fuerza.El cepillo dental, no es para cepillarse los dientes solamente. Te lo repito, no es para cepillarse los dientes: es para cepillarse la encía. Si te sabes cepillar correctamente la encía, sin darte cuenta y sin querer, también limpiarás los dientes; y no al revés.
Los cepillos del supermercado son los peores. Aunque sí sirven para fregarse los talones de los pies, o en arqueología para limpiar el polvo de lo que van desenterrando.
Los cepillos que anuncian en TV no son los mejores del mercado. Son los que más se venden. Los dientes se gastan y las encías son delicadas. Usemos un cepillo de calidad para una boca de calidad. Tú boca. El cepillo se gasta, pero se compra otro nuevo. La boca es siempre la misma. No la gastes.
Hay en España, 2 o 3 marcas de cepillos recomendables. Yo uso “VITIS” Suave – porque yo lo valgo-. Nunca el duro (el duro lo fabrican para vendérselo a la gente que no sabe lo que hace, pero hay que vendérselo). Si eres joven y con una buena boca, puedes usar el Medio. Yo también lo hacía, hasta que tuve que cambiar al suave. Los eléctricos van muy bien si son buenos.
Se gastan por usar dentífricos de calidad discutible: Las pastas dentales son como los
shampoos, hay cientos, y el mío es el que más me gusta. Sólo te quiero decir una cosa: Si tienes Sensibilidad Dentinaria, es posible que tengas que cambiar de dentífrico. No voy a recomendarte ninguno, pero busca uno que sea para dientes sensibles, y no lo cambies por el que estabas usando antes si la sensibilidad desapareció; porque volverá a aparecer.
Hay muchas cremas dentales buenas en la farmacia. Son mas caras, pero son mejores. En el supermercado casi todas son regulares o “malitas”
Se gastan por rechinar los dientes durmiendo (bruxismo)
Ya sé, tu no rechinas los dientes. Pues mucha gente lo hace, durmiendo o durante el día. Pero tú no. Para saberlo hay que ir al dentista.Las personas que aprietan y friccionan las muelas, tienen mas posibilidades de que se le gasten los cuellos dentales. Pero no siempre. El porqué y el cómo es largo de explicar.
Lo que sí se les gasta con seguridad, son las caras triturantes de las piezas dentales. Se les gasta el esmalte quedando la dentina al descubierto y pudiendo dar sensibilidad.
Tu dentista puede fabricarte una placa para usar de noche, para impedir que se gasten los dientes al rechinar. Si es que eres bruxómano. Yo uso una y me va muy bien.


Borde
incisal de dos Incisivos Centrales Superiores.IZQUIERDA: Desgaste
intenso, DENTINA al descubierto. Diente mas corto y borde plano. Típico
en la madurez. Bruxomanía.DERECHA: Desgaste leve de ESMALTE en el borde
incisal, diente mas joven.No es habitual tener sensibilidad en el borde
incisal. Pero sí en los cuellos
Se gastan por cepillarse después de comer fruta o beber gaseosas o zumos
Las frutas son alimentos sanísimos, que hay que consumir a diario y en cantidad (si no fueran tan caras). Pero todas ellas tienen ácidos. Las manzanas verdes y las naranjas son las más famosas, pero casi todas excepto el plátano, por ejemplo, son mas o menos ácidas ( uvas, ciruelas, mandarinas, pomelos, limón, etc).Contienen ácido cítrico.Cuando terminas de comer tu ración de fruta, el ácido se te quedan pegado a la dentadura. Vas tú y te cepillas con dentífrico malo, con tu cepillo duro y con fuerza para limpiar mejor. Los ácidos atacan al diente, erosionándolo y aumentando el desgaste. Abre los conductillos dentinarios y provoca la sensibilidad dentinaria. Los zumos hacen lo mismo, pero se beben, no se mastican. Hacen menos daño.
Las bebidas gaseosas, sobre todo las de “cola”, contienen acidulantes, que junto con el burbujeo del gas, se te mete en el medio de los dientes con mucha eficacia. Si la dejas en la boca un rato antes de tragar, aún es peor. Hay que beber e ir tragando sin pasarlo por los dientes.
No hay que cepillarse con pasta dental después de comer fruta o beber “Coca-Cola” o gaseosas en general. Tratar de cepillarse después de 2 horas. Pero si no es posible, cepíllate con el cepillo mojado en agua caliente y nada mas.
Enjuagarse bien con agua caliente disuelve los ácidos. Y si se enjuaga con un poquito de bicarbonato en el agua, mejor. El cepillado con dentífrico se hará mas tarde o al día siguiente.

Recomendamos
comer fruta todos los días. Es sanísimo, pero hay que seguir las
recomendaciones para que no te provoque Sensibilidad Dentinaria

Las mas peligrosas pueden ser las manzanas ácidas y los cítricos.Y no olvides las bebidas gaseosas.
Se puede tener sensibilidad dentinaria sin tener un desgaste visible del cuello y sin que la encía esté notoriamente retraída. Cuando hay desgaste, es posible, enganchar la uña en el cuello del diente.

Corte longitudinal Incisivo CentralSuperior.


Derecha: 1º premolar superior. Se aprecia el desgaste del cuello.Tiene un empaste de amalgama en la cara triturante.Radiografía del mismo premolar. Observa el marcado desgaste. La mancha blanca intensa es el empaste.El caparazón blanco que cubre la corona es el esmalte. Observa que el esmalte, termina en el cuello afinándose.El mismo premolar coloreado para ver: En negro está marcado el cemento. En rojo fuerte se aprecia la cámara pulpar. El desgaste casi llega a la pulpa. Apréciese en blanco el esmalte, que termina en el cuello a filo de cuchillo

Izquierda:
Canino superior sano y sin desgaste. Derecha: Otro Canino superior con
desgaste cervical muy evidente. Se puede restaurar con un empaste blanco
y queda perfecto.
1) Si el dolor dura mas de 3 a 5 segundos, no es sensibilidad dentinaria
2) Si el dolor dura hasta un minuto, pero luego se va, no es sensibilidad dentinaria, es una hiperemia pulpar. Una congestión de la pulpa, que “podría” ser reversible, pero necesita verlo el dentista. Podría ser una caries. Necesita atención profesional.
3) Si el dolor dura mas de un minuto y luego disminuye pero no se va del todo, es una pulpitis irreversible y necesita atención profesional.
Tratamiento de la Sensibilidad Dentinaria
Lo primero es cambiar lo malos hábitos por hábitos beneficiosos. Leer mas arriba las sugerencias. Si en 15 días no hay una mejoría o resolución del problema, HAY QUE IR AL DENTISTA.1) Comprar un cepillo VITIS SUAVE, cambiarlo cada 2 meses (6 cepillos al año)
2) Aprender técnica de cepillado correcta. Te lo tiene que enseñar tu dentista, no hay otra salida. Sólo te voy a decir que hay que apoyar el cepillo en el cuello en 45º, posicionarlo en el cuello, como queriendo “meterlo” en la encía y hacer movimientos vibratorios en círculo o en vertical. Nunca en horizontal, que hace efecto serrucho, y gasta más.
3) Dejar de usar el dentífrico habitual, y durante 20 días usar un “gel” para tratamiento de la sensibilidad:”Sensigel” gel desensibilizante del laboratorio ” Pierre Fabre”o “Desensin” gel dientes sensibles, del laboratorio “DENTAID”.Usarlos como si fuera el dentífrico habitual.
Usarlos con el cepillado como si fuera un dentífrico. Por la mañana después del desayuno y por la noche antes de acostarse. Así 20 días. Cuando termines, puedes aplicar un poco de gel con el dedo en las zonas más sensibles y luego escupir lo sobrante, pero no enjuagar con agua.
4) Comprar una botellita de “Desensin” plus,colutorio. Enjuagar con el líquido sin diluir, puro, como viene, al medio día después de comer y a la tarde después de merendar. Dejarlo en la boca 1 o 2 minutos y enjuagar con fuerza para que penetre y bañe todos los espacios interdentales. Así 20 días.
Si se trata de una sensibilidad, en 20 días tiene que desaparecer la molestia. Si no es así : habrá que ir al dentista
El “Desensin” colutorio, si te gusta, lo puedes usar todas las noches para enjuagarte antes de acostarte. También tiene efecto anticaries.
Pero después de 20 días, y superado el problema, puedes usar un “DENTÍFRICO” de mantenimiento, que es para dientes sensibles. Repito es de mantenimiento, no de tratamiento.
Para ello hay muchas marcas buenas en la farmacia. Yo recomiendo “ELGYDIUM”, “FluorKin”, o “Desensin” plus pasta dentífrica. También me gusta usar el dentífrico “VITIS” Orthodontic que tiene sabor a menta y manzana, muy original.
Hay que ir al dentista todos los años a revisión, no hay que esperar a que duela algo para ir, eso, ya lo hacen todos. No lo hagas tu.
Las fotos de los dientes, son de dientes auténticos, extraídos a nuestros pacientes. Fueron preparados y fotografiados en nuestro laboratorio. ¿Porqué extraemos dientes que están sanos? porque tenían Enfermedad Periodontal (piorrea). Que no te pase a tí lo mismo.Que tus dientes te sirvan a tí, toda la vida y no a la ciencia.
Implantes dentales de carga inmediata: más beneficios que riesgos
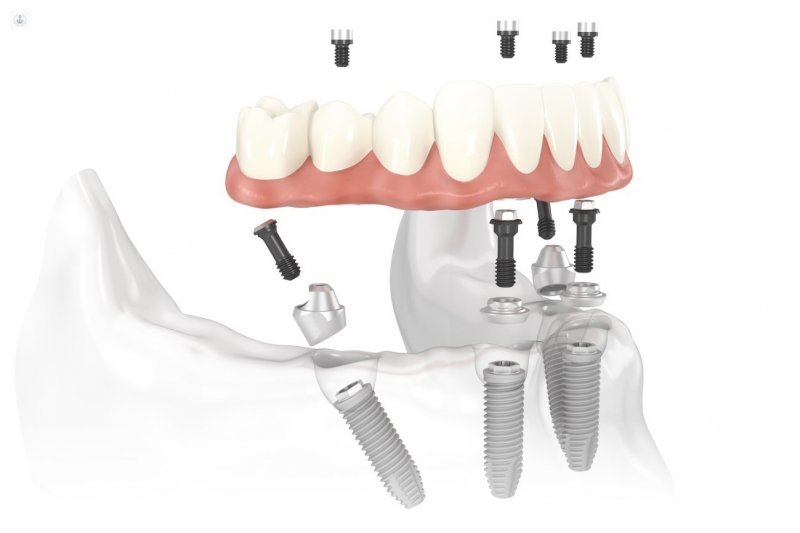
En qué consisten los implantes dentales de carga inmediata
Los implantes de carga o función inmediata nos permiten pasar en horas de una boca sin dientes o con dientes severamente defectuosos a una boca con dientes fijos nuevos.La carga inmediata supone la colocación de dientes fijos sobre los implantes el mismo día o pocos días después poner los implantes. Estos dientes suelen ser provisionales o transitorios en la mayoría de los casos, y se llevan durante el proceso llamado oseointegración (periodo de dos o tres meses durante el cual cicatriza el hueso y la encía tras colocar los implantes). Una vez transcurrido este tiempo se elaboran ya los dientes finales.
Beneficios de los implantes dentales de carga inmediata frente a otros implantes
Según afirman los expertos en Odontología y Estomatología, los beneficios son importantes, tanto desde el punto de vista funcional como psicológico.Hay que tener en cuenta que, si no empleamos la carga inmediata, las personas a las que colocamos los implantes se ven obligadas a no llevar dientes durante ese periodo de espera, o bien a llevar incómodas prótesis de poner y quitar. Mediante la carga inmediata mejoramos mucho la vida de las personas durante esa fase del tratamiento, ya que pueden comer con mayor comodidad.
Y, desde el punto de vista psicológico y social, el hecho de llevar unos dientes fijos desde el primer momento facilita enormemente las relaciones sociales y, evidentemente, mejora rápidamente la autoestima.
Qué tipo de pacientes pueden someterse a implantes dentales de carga inmediata
En principio la carga inmediata se puede llevar a cabo en la mayor parte de situaciones. Lo que nos va a condicionar la posibilidad de realizar la carga inmediata es que podamos situar los implantes en las localizaciones apropiadas y, que al colocarlos, los implantes queden lo suficientemente sólidos o estables.Riesgos de los implantes dentales de carga inmediata
La carga inmediata es una modalidad de tratamiento extremadamente segura, siempre que se haya estudiado bien el caso y el procedimiento clínico se lleve a cabo con rigor. Desde luego, la experiencia es un factor más importante que cuando el tratamiento se hace mediante protocolos convencionales.Algunas situaciones, tales como la sustitución de dientes individuales, exigen una colaboración mayor por parte del paciente, durante la fase de espera u oseointegración.
Estética dental, creadora de sonrisas perfectas
La
estética es una rama del arte que se relaciona con la percepción de la
belleza y de la armonía. Esto, dirigido al campo dental, nos lleva a la
odontología estética o estética dental.
En la actual sociedad, la apariencia es uno de los valores más buscados, pero los profesionales en Odontología siempre lo tendrán en cuenta junto con la salud y la función bucodentales.
¿Qué es la estética dental?
La estética dental lleva al paciente a conseguir una sonrisa armónica, buscando un equilibrio entre las líneas horizontales y verticales de la cara y de los dientes.En la actual sociedad, la apariencia es uno de los valores más buscados, pero los profesionales en Odontología siempre lo tendrán en cuenta junto con la salud y la función bucodentales.
Tratamientos en la estética dental
Según los especialistas en Odontología, entre los tratamientos estéticos más realizados se encuentran los siguientes:- Carillas dentales: también denominadas carillas estéticas, es una técnica basada en el recubrimiento de la pieza afectada con el fin de mejorar su aspecto. Asimismo, éstas sirven para mejorar dientes con problemas patológicos causados por caries, fracturas, cambios de color, etcétera.
- Recontorneado estético dental: este tratamiento se basa en pulir y modelar los dientes para darles una forma más armónica con el objetivo de dar una mayor estética y lograr una armonía con el rostro en el que están enmarcados los dientes, siempre teniendo en cuenta la oclusión del paciente y tratando de evitar las fracturas.
- Blanqueamiento: este tratamiento, quizá uno de los más conocidos, se basa en la reducción tonal de las piezas dentales, volviéndolas más blancas y brillantes.
Cómo conservar una boca sana
Para mantener una boca sana y estética, es imprescindible mantener una higiene correcta, utilizando el cepillo adecuado y los complementos que mejor se adapten a las necesidades de cada paciente (hilo dental, colutorio, etc.). Además, se debe revisar la dentadura mínimo una vez al año, y hacer el mantenimiento de todos los tratamientos efectuados anteriormente con cierta periodicidad.Qué saber sobre los implantes dentales
Los
implantes dentales permiten al paciente mantener su dentición,
restaurar la función para comer con comodidad y seguridad, así como
restablecer la estética perdida.
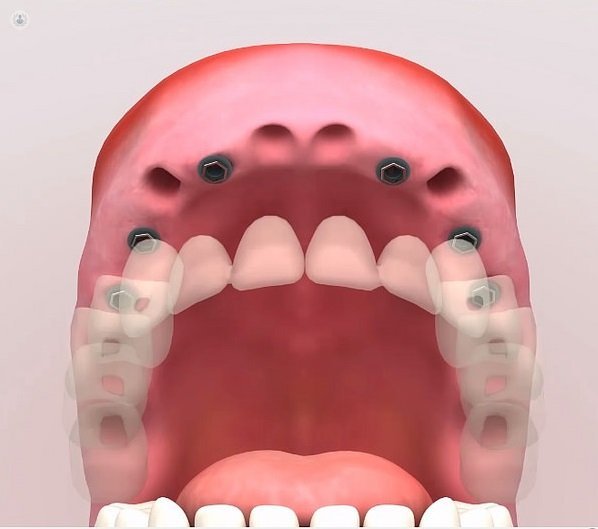 Los
implantes dentales son unas raíces artificiales que se instalan,
sumergen o implantan en el hueso mandibular o maxilar del paciente,
creando así una pieza sólida para poder colocar sobre ellos las prótesis
dentales, parciales o totales, con el objetivo de restaurar la función y
la estética pérdidas o deterioradas. Podemos decir que la técnica
consiste en labrar un lecho óseo maxilar o mandibular donde luego irá
posicionado el implante.
Los
implantes dentales son unas raíces artificiales que se instalan,
sumergen o implantan en el hueso mandibular o maxilar del paciente,
creando así una pieza sólida para poder colocar sobre ellos las prótesis
dentales, parciales o totales, con el objetivo de restaurar la función y
la estética pérdidas o deterioradas. Podemos decir que la técnica
consiste en labrar un lecho óseo maxilar o mandibular donde luego irá
posicionado el implante.
Qué son los implantes dentales
 Los
implantes dentales son unas raíces artificiales que se instalan,
sumergen o implantan en el hueso mandibular o maxilar del paciente,
creando así una pieza sólida para poder colocar sobre ellos las prótesis
dentales, parciales o totales, con el objetivo de restaurar la función y
la estética pérdidas o deterioradas. Podemos decir que la técnica
consiste en labrar un lecho óseo maxilar o mandibular donde luego irá
posicionado el implante.
Los
implantes dentales son unas raíces artificiales que se instalan,
sumergen o implantan en el hueso mandibular o maxilar del paciente,
creando así una pieza sólida para poder colocar sobre ellos las prótesis
dentales, parciales o totales, con el objetivo de restaurar la función y
la estética pérdidas o deterioradas. Podemos decir que la técnica
consiste en labrar un lecho óseo maxilar o mandibular donde luego irá
posicionado el implante.Tipos y materiales de implantes dentales
En la historia de los implantes dentales se han desarrollado varias formas y diferentes tipos, buscando siempre una unión hueso-implante rápida, intensa y estable en el tiempo. En este desarrollo científico se han estudiado también diferentes materiales, llegando hoy día a la conclusión de que el mejor material para la fabricación de los implantes es el titanio (puro o en aleación), pues se considera el metal más biocompatible que existe con el hueso humano.Ventajas de los implantes dentales
- Los implantes son el mejor sustituto de los dientes naturales perdidos, pues permiten una vez colocada la prótesis, recuperar la funcionalidad y la estética.
- Rehabilitar la función de la pieza dental
- Masticar con comodidad y seguridad.
- Rehabilitar su aspecto estético.
- Practicar una perfecta fonación.
- Eliminar el trauma psicológico de no tener dientes.
Duración media de un implante dental
Explican los especialistas en Odontología que, aunque los implantes se presuponen como tratamientos de larga duración, no se puede determinar cuál es la vida media de un implante en boca porque su durabilidad depende de muchos factores asociados con las características del paciente.lunes, 4 de enero de 2016
jueves, 31 de diciembre de 2015
miércoles, 2 de septiembre de 2015
Mes de la Salud Bucodental 2015
Se inicia una nueva edición del “Mes de la Salud Bucodental” de Colgate, con la colaboración de SEPA



 Con el objetivo de aumentar la concienciación social sobre la trascendencia de una correcta higiene y salud bucodental, Colgate ha puesto en marcha una nueva edición de su ya clásica campaña informativa. El "Mes de la Salud Bucodental", que cuenta con la colaboración de SEPA, es un proyecto dirigido al gran público que persigue el objetivo de animar a los ciudadanos a visitar periódicamente la clínica dental. Respecto a ediciones anteriores, se han introducido algunas importantes novedades. Más información, aquí
Con el objetivo de aumentar la concienciación social sobre la trascendencia de una correcta higiene y salud bucodental, Colgate ha puesto en marcha una nueva edición de su ya clásica campaña informativa. El "Mes de la Salud Bucodental", que cuenta con la colaboración de SEPA, es un proyecto dirigido al gran público que persigue el objetivo de animar a los ciudadanos a visitar periódicamente la clínica dental. Respecto a ediciones anteriores, se han introducido algunas importantes novedades. Más información, aquí
En esta campaña de revisiones dentales gratuitas se cuenta con el apoyo y aval científico de SEPA, y se desarrolla exitosamente gracias a la colaboración de miles de dentistas que ejercen en nuestro país.
Para participar en el Mes de la Salud Bucodental de Colgate y SEPA, y poder así ganar tratamientos dentales gratuitos, los interesados tienen que visitar la web www.colgate.es, donde podrán registrarse para los chequeos dentales gratuitos. La aplicación de Google Maps les indicará los consultorios asociados disponibles más cercanos a su domicilio.
Para participar en el Mes de la Salud Bucodental de Colgate y SEPA, y poder así ganar tratamientos dentales gratuitos, los interesados tienen que visitar la web www.colgate.es, donde podrán registrarse para los chequeos dentales gratuitos. La aplicación de Google Maps les indicará los consultorios asociados disponibles más cercanos a su domicilio.
Además, en la misma página web, los usuarios podrán registrarse para participar en el sorteo diario de 250€ por la compra de cualquier producto Colgate, conservando el ticket de compra. Los ganadores se anunciarán semanalmente en la web.
"El Mes de la Salud Bucodental" de Colgate ha permitido desde 2.002 la realización de más de 51.000 chequeos dentales gratuitos entre la población española. Como cada año, SEPA se ha unido a esta campaña junto a los profesionales de la salud dental, colaborando en este esfuerzo común en favor de una buena higiene bucodental entre sus ciudadanos.
"El Mes de la Salud Bucodental" de Colgate ha permitido desde 2.002 la realización de más de 51.000 chequeos dentales gratuitos entre la población española. Como cada año, SEPA se ha unido a esta campaña junto a los profesionales de la salud dental, colaborando en este esfuerzo común en favor de una buena higiene bucodental entre sus ciudadanos.
domingo, 9 de agosto de 2015
BIOFILM
Placa dental (bacteriana o biofilm) ¿Qué es?
La placa dental es un cúmulo de diferentes tipos microbios (aerobios, viven en presencia de oxígeno y anaerobios, viven en ausencia de oxígeno) rodeados y unidos por una matriz de origen salivar y microbiana.
Anteriormente se llamaba a la placa dental, placa bacteriana. Este nombre cambió debido a que descubrieron otros tipos de microorganismos (hongos, virus) no bacterianos en su constitución. El nombre más actual de la placa dental, pero todavía no muy difundido, es de biofilm dental u oral.
La placa dental es blanda y de color blanco amarillenta. Se puede ver a simple vista cuando lleva muchos días de formación, pero no siempre es así. Se acumula sobre las piezas dentales, la encía y sobre las restauraciones dentales en pocas horas. Para verla mejor a simple vista y saber donde realizar la higiene dental en forma más precisa, se utilizan sustancias "reveladoras de placa", que pueden venir en comprimidos o líquidos que se introducen en la boca y tiñen de un color llamativos la placa dental.
La placa dental calcificada se denomina sarro o cálculo dental.
 |
| Revelado de placa dental con "revelador de placa dental" |
A continuación una explicación más detallada de su composición:
Matriz
Entramado orgánico de origen bacteriano, formado por restos de la destrucción de bacterias y compuestos sintetizados por las propias bacterias a partir de los azúcares de la dieta. Tiene tres funciones: sujeción, sostén y protección de las bacterias de la placa.
Bacterias cariogénicas
a) Estreptococos: mutans, sobrinus, sanguis, salivalis. Son los que inician las caries. Tienen propiedades acidúricas: desmineralizan esmalte y dentina.
b) Lactobacilus casei: Es acidófilo, continúa las caries ya formadas, son proteolíticos: desnaturalizan las proteínas de la dentina.
c) Actinomyces: viscosus, naeslundii. Tienen acción acidúrica y proteolítica, continúan la caries.
¿Qué es la película adquirida?
Es una película orgánica e insoluble que se forma de manera natural y espontánea en la superficie dentaria, es de origen salival, libre de elementos celulares. Se forma por depósitos salivales en la superficie del diente. Esto lo produce la propia saliva de cada individuo.
Esta película de origen salival protege al diente de la descalcificación, impidiendo la penetración de los ácidos y el egreso de minerales desde la superficie del diente hacia el medio.
Pero a su vez también facilita la colonización bacteriana facilitando la adherencia de los microorganismos a la superficie dental.
Ojo! La saliva es muy importante por que posee elementos de defensas frente a estos y otros microorganismos y sin ella seriamos susceptibles a muchas otras enfermedades.
En nuestra cavidad bucal existen muchas cantidades y tipos de microorganismos que deben existir para una buena salud y debe ser así. Solamente se debe mantener a raya, a todos esto microrganismos para que no se organicen y puedan producir alguna enfermedad. Esto se logra con una correcta higiene oral y una dieta balanceada.
¿Qué enfermedad puede producir la placa dental o biofilm dental?
- Gingivitis: Inflamación de la encía provocada por la presencia de placa dental. Hay diferentes tipos y puede ser favorecido por otros factores.
- Enfermedad periodontal (periodontitis o comunmente llamada piorrea): Empieza como una gingivitis, a diferencia de esta, también afecta al hueso y los tejidos de sostén del diente (ligamento periodontal). Tienen que existir factores de riesgo que la favorezcan (genéticos, enfermedades sistémicas, tabaco, etc).
- Caries: Afecta al tejido dental (esmalte y dentina) produciendo una desmineralización por los ácidos producidos por la placa dental a partir de los hidratos de carbono de la dieta.
Las bacterias que se encuentran en la saliva pueden ser consideradas bacterias planctónicas (bacterias que flotan en una fase líquida). Sin embargo, las bacterias que se encuentran en una superficie dura (diente, reconstrucciones, prótesis e implantes) forman una película gelatinosa adherente: la placa dental. La placa dental es el principal agente etiológico de la caries y de las enfermedades periodontales1.
El concepto y la apariencia de la placa dental han ido variando a lo largo de la historia dependiendo de los medios técnicos disponibles para su estudio. Así, con la aparición del microscopio óptico, Anthony van Leeuwenhoek observó en 1683 que la placa dental estaba compuesta por depósitos blandos con microbios y restos de comida. Posteriormente, en 1898, Black definió la placa dental, como placas blandas gelatinosas. En 1965, Egelberg y cols determinaron los estadios en la formación de la placa dental. Estos autores definieron:
- Un primer estadio o fase I, en la que se formaría una biopelícula sobre la superficie limpia del diente. Esta biopelícula estaría compuesta fundamentalmente por glicoproteínas.
- Un segundo estadio o fase II. En esta fase se observa la adhesión de unos determinados tipos de bacterias a la biopelícula previamente formada.
- Fase III. Se produce multiplicación bacteriana.
- Fase IV. Debido a la multiplicación bacteriana de la fase anterior y a la aparición de nuevas condiciones, se produce la coagregación de nuevas especies bacterianas.
En 1970, en el congreso de Edimburgo, se definió la placa dental como microorganismos más polisacáridos extracelulares; esta placa dental estaba recubierta por leucocitos, células epiteliales y restos de comida.
En los años 90, gracias al desarrollo y perfeccionamiento del microscopio confocal de láser, se llegó a un mejor conocimiento de la placa dental y de su estructura, y se desarrolló el modelo de la placa dental como biofilm2*-6. Los biofilm presentan unas características que plantean una serie de problemas en cuanto a su eliminación.
Definición de biofilm
Un biofilm es la forma de crecimiento más frecuente de las bacterias y se definió en un principio como una comunidad de bacterias adheridas a una superficie sólida e inmersa en un medio líquido (Costerton 1987)7. Posteriormente, Costerton definió el biofilm como: «una comunidad bacteriana inmersa en un medio líquido, caracterizada por bacterias que se hallan unidas a un substrato o superficie, o unas a otras, que se encuentran embebidas en una matriz extracelular producida por ellas mismas, y que muestran un fenotipo alterado en cuanto al grado de multiplicación celular o la expresión de sus genes»8.
Esta definición caracteriza las propiedades del biofilm y se diferencia de la desarrollada por Costerton en 1987: bacterias o comunidades bacterianas unidas o fijadas a una superficie en un medio ambiente acuático, embebidas en una matriz o glicocálix. Podemos encontrar bacterias que crecen en superficie de agar con estas características pero que, en cambio, no muestran las propiedades de resistencia típicas de los biofilm; del mismo modo, podemos encontrar «fragmentos » procedentes de un biofilm que no se encuentran unidos a una superficie, pero que mantienen todas las características propias de los biofilms3,6,8*.
¿Cómo se desarrolla el biofilm?
Los biofilms pueden desarrollarse por medio de dos tipos de procesos:
• A partir de una célula planctónica
• A partir de otro biofilm
A partir de una célula planctónica
Ciertas bacterias muestran o tienen la capacidad de desarrollar estructuras de superficie que favorecen la adhesión de las mismas a una superficie sólida, tales como fimbrias y fibrillas. Así, colonizadores primarios como Actinomyces naeslundii, varias especies de estreptococos, como Streptococcus salivarius, Streptococcus parasanguis, Streptococcus mitis, muestran fimbrias y fibrillas en su superficie. Otros factores que favorecen la adhesión de las bacterias a una superficie son la capacidad que muestran algunas especies bacterianas para el movimiento, como la Pseudomonas aeruginosa, Pseudomonas fluorescens, Escherichia coli, o la expresión de ciertas proteínas en su superficie celular, denominadas adhesinas.
Existen una serie de factores que afectan a la adhesión de las bacterias a una superficie sólida. Por un lado, factores físicos y químicos de la superficie, como su rugosidad y composición química, y factores del medio líquido en el que se desarrolla, como la velocidad del flujo y la composición química del mismo9**,10*.
Una vez que las bacterias están ya adheridas a una superficie sólida se produce la expresión de ciertos genes que las diferencian de las formas planctónicas. Posteriormente se produce la multiplicación de la especie bacteriana y la coagregación con otras especies bacterianas. Dentro del biofilm, esta asociación de especies no sería aleatoria, sino que existirían asociaciones específicas entre bacterias dentro del biofilm9.
A partir de otro biofilm
Los biofilms también se pueden desarrollar a partir de células sueltas desprendidas de un biofilm o de partes del propio biofilm. En cualquier caso, estas células desprendidas mantendrían todas las propiedades del biofilm de donde proceden. También se han descrito fenómenos de movimiento del biofilm sobre la superficie a la que se encuentra fijado9**.
Estructura del biofilm
Cuando se observa un biofilm con el microscopio confocal de láser, pueden observarse las distintas comunidades bacterianas (dentro de las cuales pueden presentarse vacíos) organizadas en forma de seta o torre y separadas entre sí por microcanales de agua (fig. 1)6,9**,11.

El biofilm está compuesto por bacterias, que representan un 15%- 20% del volumen, y una matriz o glicocálix, que representaría el 75% - 80%. Esta matriz está compuesta por una mezcla de exopolisacáridos, proteínas, sales minerales y material celular9. Los exopolisacáridos representan el componente fundamental de la matriz y son producidos por las propias bacterias del biofilm. Los exopolisacáridos participan de forma fundamental en el desarrollo del biofilm, pues su intervención mantiene la integridad del todo. Pueden tener carga neutra o carga polianiónica, según el tipo de exopolisacárido, por lo que pueden interactuar con distintos antimicrobianos, de forma que estos últimos quedan atrapados en la matriz sin capacidad para actuar sobre las bacterias. Los propios exopolisacáridos producidos por unas bacterias pueden actuar como fuente de nutrientes para otras bacterias y, de la misma forma, pueden atrapar otros nutrientes del medio y ofrecerlos a los distintos tipos bacterianos presentes en el biofilm, lo cual supone una ventaja para el desarrollo bacteriano. Los exopolisacáridos actúan también retirando desechos del medio, lo que también favorece el desarrollo bacteriano. La composición química y la estructura terciaria de los exopolisacáridos determinan la capacidad de adhesión de los mismos lo que a su vez favorece la adhesión de las bacterias a las superficies. Por último, los exopolisacáridos participan en funciones de protección de las bacterias, pues evitan su desecación. Además, gracias a sus cualidades pueden «tamponar» la acción de distintos antimicrobianos. La pérdida o alteración de un determinado polisacárido puede alterar el biofilm, o incluso puede producir la desaparición del mismo12,13.
Propiedades de los biofilms
Heterogeneidad fisiológica
Dentro del biofilm puede observarse un rango muy amplio de micronichos, separados unos de otros por mínimas distancias. Se pueden encontrar, asimismo, ambientes muy diferentes en cuanto al contenido de nutrientes del medio, tensión de O2, tensión de CO2, pH, etc. Por lo tanto, células de la misma especie bacteriana pueden presentar estados fisiológicos muy diferentes, y también pueden encontrarse especies bacterianas con distintas necesidades fisiológicas (anaerobias, aerobias, microaerobias), separadas entre sí por sólo 10µm6,9**,14,15.
Fenotipos en el biofilm
Cuando las bacterias crecen en el biofilm, en forma sésil, manifiestan un fenotipo diferente respecto del que manifiestan cuando crecen en forma planctónica. Los fenotipos de las bacterias que crecen en los biofilms son más resistentes frente a diversos antimicrobianos y mantienen esta resistencia incluso cuando se desprenden del biofilm9**.
Señales en el biofilm
Dentro del biofilm, las bacterias tienen capacidad para comunicarse entre ellas, ya sea por medio de señales químicas o incluso mediante transferencia de material genético a través de mecanismos tales como la conjugación, la transformación, la transferencia de plásmidos y la transferencia de trasposones9**,11.
Dentro de dicha capacidad comunicativa mediante señales químicas es importante el fenómeno de «Quorum Sensing», es decir, la regulación de la expresión de ciertos genes a través de la acumulación de compuestos de señalización. Esta acumulación de señales químicas depende de la densidad bacteriana. El «Quorum Sensing» puede proporcionar a los biofilms algunas de sus propiedades características, tanto en lo tocante al desarrollo de los mismos, como a la mayor resistencia frente a los antimicrobianos. Por ejemplo, puede promover la expresión de genes codificantes para la resistencia a un determinado antibiótico a partir de cierta densidad celular; tendría también capacidad para influir en la estructura del biofilm, estimulando el crecimiento de especies beneficiosas para el mismo e inhibiendo el crecimiento de las especies competidoras9**.
La capacidad que poseen las bacterias de comunicarse entre sí tiene influencia en la resistencia bacteriana frente a los antimicrobianos, en la producción de factores de virulencia y en la estructura del propio biofilm.
Capacidad adaptativa
Los biofilm deben mantener un equilibrio, por un lado, entre el crecimiento en condiciones favorables en cuanto a aporte de nutrientes y de medio ambiente, y por otro, el mantenimiento de su estructura.
En condiciones desfavorables, el biofilm puede involucionar a estadios anteriores, pero en casi todas las situaciones se mantiene como parte del mismo y unido a la superficie, pudiendo volver a desarrollarse cuando las condiciones mejoran.
Ventajas de los biofilms
Una vez revisadas las propiedades del biofilm se constata que las bacterias que crecen en esta forma van a presentar una serie de ventajas6,9**:
1. Protección frente a agresiones externas y mayor resistencia frente a los antimicrobianos14,16.
2. Ventajas nutricionales: aporte de nutrientes y eliminación de desechos.
3. Proporciona un medio ambiente adecuado para el desarrollo bacteriano.
4. Capacidad de intercomunicación entre las bacterias.
Resistencia frente antimicrobianos
Dentro de estas ventajas, merece la pena destacar la mayor resistencia frente a los distintos antimicrobianos. Esta cualidad puede deberse a:
1. Los antimicrobianos van a llegar en menores concentraciones (concentraciones no efectivas frente a las bacterias) a las zonas profundas del biofilm8,9**,14.
2. Las bacterias, al ser atacadas con dosis subletales tienen capacidad para desarrollar resistencia frente a los antimicrobianos (entrenamiento de resistencia con dosis subletales)8,9**,14.
3. Al crecer en forma sésil, las bacterias activan genes que proporcionan mayor resistencia frente a los antimicrobianos en comparación con las formas planctónicas8,9**,14.
4. En zonas profundas del biofilm, que tienen un menor aporte de nutrientes, las bacterias estarían en forma quiescente, que es un estado bacteriano no susceptible a los antimicrobianos8,9**, 14.
5. Las bacterias estarían protegidas por la matriz de exopolisacáridos frente a los antimicrobianos8,9**,14,16.
Esta mayor resistencia de las bacterias cuando crecen en biofilm se traduce en que, para que sea efectivo, se deben multiplicar incluso por mil las concentraciones necesarias del antimicrobiano. Esto explicaría en parte por qué a veces no concuerdan los resultados clínicos con los resultados obtenidos in vitro.
Se ha visto que al crecer en forma sésil, las bacterias presentan mayor resistencia frente a los distintos antimicrobianos, por lo que se puede cuestionar que los distintos productos de los que disponemos sean realmente útiles. De hecho, se están desarrollando nuevas investigaciones en modelos de boca artificial dirigidos a comprobar la eficacia de los antimicrobianos frente a los biofilms. De entre los distintos colutorios que existen en el mercado, solamente se han publicado estudios sobre colutorios de clorhexidina y colutorios de aceites esenciales, quedando demostrada en ambos casos la capacidad de los mismos para penetrar en el biofilm y producir una acción bactericida suficiente16.
Enfermedades causadas por los biofilms
Al penetrar en el organismo, las bacterias producen una serie de enfermedades infecciosas que pueden clasificarse en:
- Agudas: producidas por agentes exógenos, tienen un inicio rápido y se desarrollan en días o semanas. Los microorganismos o sus productos entran en el cuerpo. La infección se suele resolver de forma rápida. Ejemplos de este tipo de infecciones son los abscesos locales producidos por Staphylococcus aureus, las infecciones de las vías respiratorias superiores o las infecciones gastrointestinales.
- Crónicas: están producidas por microorganismos exógenos que penetran en el organismo y persisten durante largos periodos, ya que las defensas del organismo no son capaces de eliminarlos. La lepra y la tuberculosis son ejemplos de este tipo de infecciones.
- Retardadas: los signos y síntomas de la enfermedad no aparecen hasta meses o años tras la infección inicial. Las lesiones producidas pueden persistir toda la vida. Se caracterizan por un inicio poco evidente, para manifestarse posteriormente con otros síntomas y signos. Ejemplo de este tipo de infecciones son la sífilis, la fiebre reumática, la enfermedad de Lyme y úlceras gastrointestinales9.
Estos tres tipos de infecciones cumplen los criterios de Koch8.
Infecciones producidas por biofilms: la principal característica de estas infecciones es que son causadas por gérmenes presentes fuera del organismo9**. Este tipo de infecciones no cumplen estrictamente los postulados de Koch, sino que existe una asociación estadística entre la presencia del biofilm y la aparición de la enfermedad8*.
Son varios los tipos de infecciones causadas por biofilms. Podemos destacar las siguientes: endocarditis bacteriana, otitis media, prostatitis crónica, fibrosis quística, y en el ámbito de la cavidad oral, la caries y la periodontitis8*, 9**,17-19. El tratamiento de este tipo de infecciones requiere abordaje por medios físicos, antimicrobianos y ecológicos. También se han descrito infecciones en diversos tipos de prótesis: en prótesis totalmente implantadas, como las prótesis valvulares; prótesis parcialmente implantadas, como catéteres endovenosos; y en prótesis no implantadas, como los catéteres urinarios, lentes de contacto y dispositivos intrauterinos. La invasión de estas prótesis por los biofilms obliga a largos tratamientos de combinaciones de antibióticos o incluso a la eliminación de las mismas6,9**.
¿Cómo actuar frente a los biofilms?
Como se ha comprobado por lo presentado hasta ahora, al organizarse en biofilm, las bacterias se convierten en adversarios a tener en cuenta, pues son más resistentes a las distintas actuaciones encaminadas a combatirlas.
Frente a los biofilms podemos actuar:
1. Evitando o retrasando la aparición de los mismos.
Se pueden realizar cambios en las características físicas y/o químicas de las superficies a las que se adhieren los biofilm, de forma que se impida o retrase la adhesión de los mismos.
También se podría actuar sobre el medio líquido de crecimiento del biofilm9**, 10*.
Se pueden realizar tratamientos que cambien el medio ambiente bacteriano (tratamiento ecológico), lo que imposibilitaría el desarrollo de determinados biofilms; de esta forma, mediante un buen control de la placa supragingival, se produciría un cambio en las condiciones ambientales subgingivales, dificultando el desarrollo de biofilms patógenos20.
2. Una vez el biofilm se ha desarrollado, fundamentalmente podría actuarse de dos formas para eliminarlos:
- por medios físicos.- Siendo la cavidad oral de fácil acceso, se pueden eliminar los biofilms por medios físicos, bien a nivel supragingival (por medio del cepillado y profilaxis dental), bien a nivel subgingival (por medio de raspado y alisado radicular, o cirugía periodontal).
- por medios químicos.
-A nivel supragingival se pueden utilizar distintos antisépticos, y a nivel subgingival distintos antibióticos y antisépticos. Para que estos productos consigan el mayor efecto posible, sería deseable producir de forma física una desestructuración previa del biofilm4,13,21,22,23**,24,25.
Estudios sobre la acción de los colutorios en los biofilms
Los distintos colutorios deben pasar una serie de estudios que atestigüen su inocuidad para el ser humano y la eficacia en el control de los biofilms. Hasta el momento, los estudios encaminados a comprobar la eficacia de un determinado colutorio se realizaban, en primer lugar, mediante estudios in vitro con bacterias planctónicas. Sin embargo, se ha visto que la forma natural de crecimiento de las bacterias en la cavidad oral es en biofilm, y cabe repetir que éstos presentan mayor resistencia a los antimicrobianos. Por lo tanto, se deben realizar estudios que demuestren la eficacia de los distintos colutorios para penetrar en el biofilm y producir una acción bactericida adecuada. En este sentido se disponen de los siguientes estudios:
Estudios «in vitro»
De los estudios in vitro se pueden destacar los estudios de Fine y col (2001)16 y de Shapiro23**. En el estudio de Fine se investigó la actividad bactericida de distintos colutorios sobre dos cepas de Actinobacillus actinomycetemcomitans (CU 1000 y NJ 4309), que crecen normalmente en forma sésil, pero que de forma espontánea pueden crecer en forma planctónica, (variantes CU 1060 y NJ 4350). Este autor observó que todos los colutorios estudiados (aceites esenciales, fluoruro estañoso y triclosán) son capaces de eliminar el 99,99% de las formas planctónicas, pero sólo los aceites esenciales son capaces de eliminar el 98,20% y el 96,47% de las cepas sésiles CU 1000 y NJ 4309.
En el estudio de Shapiro (fig. 2), que comparó la capacidad bactericida de distintos colutorios en un modelo de boca artificial frente al agua destilada. Se observó que todos los colutorios estudiados produjeron una reducción en el número de unidades formadoras de colonias estadísticamente significativa si se comparaba con el agua destilada. Los colutorios basados en los extractos de plantas son los que presentaron menor actividad (reducciones del orden de 0,5 y 1 log10 unidades formadoras de colonias, que representaba una reducción del 6% respecto del placebo). El colutorio de triclosán mostró unos resultados que se encontraron entre los obtenidos por los extractos de plantas y los aceites esenciales. En general, los colutorios de aceites esenciales presentaron una actividad bactericida menor que los que contenían clorhexidina, pero tan efectiva como alguna de las clorhexidinas que se encuentran en el mercado (con los aceites esenciales se consiguieron reducciones del orden de >3 log10unidades formadoras de colonias, que representa una reducción del 35,4 % respecto del placebo). Los colutorios de clorhexidina son los que mostraron mayor efecto bactericida, pero no todas las marcas comerciales presentaron la misma eficacia, dependiendo de la formulación con la que se fabricaron. Los resultados obtenidos por Shapiro para los distintos colutorios de clorhexidina que se ofertan en el mercado están de acuerdo con los obtenidos por Herrera y cols26, en cuyo estudio también se observaron diferencias en la efectividad de la clorhexidina dependiendo de la formulación en la que se presente. En cuanto a los colutorios de hexetidina, el rango de resultados fue muy amplio, pero menor que los resultados obtenidos por la clorhexidina y mayor que triclosán y los colutorios de extractos de plantas23**.

Modelos de estudio «in vivo»
Una vez que un determinado colutorio muestra su eficacia en los estudios in vitro, el siguiente paso consiste en observar la efectividad de los mismos en modelos de estudio in vivo para analizar las posibles interacciones del producto con el medio bucal, con la saliva, con otros productos utilizados en la higiene bucal, la sustantividad del producto, etc.
Dentro de los estudios in vivodestacan los estudios de Pan, Netuschil y Arweiler22,24,27*-29*. En este tipo de estudios se pidió a una serie de voluntarios que se abstuviesen de cualquier tipo de higiene bucal durante un periodo de tiempo (de uno a tres días), transcurrido el cual se les solicitó que se enjuagaran, bien con el colutorio test, bien con uno placebo, durante unos segundos. Se recogieron muestras de placa dental de los voluntarios, se dejó un tiempo de aclaramiento (una semana) y se repitió el proceso cambiando la asignación de los colutorios. Las muestras de placa recogidas se tiñieron mediante un proceso que mostró la vitalidad de las bacterias presentes en la placa. Así, en los estudios de Pan se encontró que los colutorios de aceites esenciales fueron capaces de producir una mortalidad del 78,7% de las bacterias frente al 27,9% producido por el colutorio control (suero salino). En los estudios de Netuschil se mostró que los colutorios de clorhexidina fueron capaces de penetrar en el biofilm y tener gran capacidad bactericida. En los estudios de Arweiler, se observó que la capacidad de los colutorios formulados con triclosán poseen muy poca capacidad para disminuir la vitalidad del biofilm, y que la actividad de los colutorios de clorhexidina dependió de la formulación de los mismos22,24.
Ensayos clínicos a seis meses
Hay que señalar, por último, que para validar el uso de un determinado colutorio de uso domiciliario es necesario realizar ensayos clínicos que sigan los criterios de la ADA21, es decir:
- La población de estudio debe representar a los usuarios del producto.
- El producto de estudio debe ser usado en un régimen normal y debe existir un control, bien negativo, o placebo, o un control positivo.
- Debe ser un estudio paralelo o cruzado.
- Los estudios deben tener como mínimo seis meses de duración.
- Se requieren, por lo menos, dos estudios realizados por investigadores independientes.
- Deben tomarse muestras microbiológicas para estudiar la placa no sólo cuantitativamente, sino también cualitativamente.
- Deben tomarse índices de placa y gingivitis al inicio, a los seis meses y en un periodo intermedio.
- Comprobar los posibles efectos secundarios que pudieran surgir30*.
De los colutorios que existen en el mercado, solamente los aceites esenciales y la clorhexidina disponen de este tipo de estudios y han obtenido resultados favorables en cuanto a la reducción de los índices de placa y gingivitis, y por lo tanto han sido aceptados por la ADA21.

Conclusiones
1. Las bacterias se organizan en la cavidad oral en forma de biofilms.
2. Las bacterias en los biofilms presentan mayor resistencia frente a los antimicrobianos. Esta mayor resistencia se debe, fundamentalmente, a la acción protectora de la matriz y a la expresión de unos fenotipos más resistentes. Para que los antimicrobianos consigan el mayor efecto posible debe realizarse una desestructuración previa del biofilm por medios físicos (cepillado, uso de hilo dental, profilaxis, raspado y alisado radicular, etc.)
3. Los estudios in vitro realizados hasta ahora fueron realizados en bacterias con fenotipos planctónicos, que no simulan las condiciones del biofilm. Los estudios in vitro deberían realizarse en modelos artificiales de los biofilms bucales o «bocas artificiales». Se han realizado algunos estudios en los que se investiga la acción de algunos colutorios en bocas artificiales. El resultado de estos estudios muestra que los colutorios con clorhexidina siguen siendo los más efectivos en su acción bactericida sobre el biofilm, pero no todos los colutorios con clorhexidina muestran la misma efectividad, dependiendo de la formulación que presenten. Otros colutorios (aceites esenciales, octenidina, fluoruro estañoso, hexetidina) muestran una correcta acción bactericida, pero menor que la clorhexidina. Los colutorios con extractos de plantas y los colutorios con triclosán muestran una actividad bactericida escasa en este tipo de estudios.
4. Además de los estudios in vitro, se deben realizar modelos de estudios in vivo a corto plazo para observar las interacciones de los colutorios con el medio bucal (sustantividad del producto, interacción con los componentes de la saliva, interacción con otros productos de la higiene bucal, etc). De los estudios in vivo realizados, los aceites esenciales y la clorhexidina han demostrado su eficacia para penetrar en el biofilm y presentar acción bactericida.
5. Los colutorios de uso domiciliario deben demostrar su eficacia mediante ensayos clínicos de una duración mínima de seis meses que cumplan las normas de la ADA. Actualmente sólo los colutorios con aceites esenciales y los colutorios con clorhexidina, han mostrado resultados positivos en este tipo de estudios y han sido aprobados por la FDA.
Bibliografía recomendada
Para profundizar en la lectura de este tema, el/los autor/es considera/an interesantes los artículos que aparecen señalados del siguiente modo: *de interés **de especial interés.
1. Fine DH. Mouthrinses as adjuncts for plaque and gingivitis management. A status report for the American Journal of Dentistry. Am J Dent 1988;1:259-63. [ Links ]
2.* Bernimoulin JP. Conceptos recientes sobre formación de placa. J Clin Periodontol 2003;30:7-9. [ Links ]
La placa dental es un biofilm bacteriano adherente. Es el agente etiológico principal de las enfermedades periodontales. Los datos disponibles muestran que los colutorios de clorhexidina y los de aceites esenciales tienen los mejores efectos antimicrobianos.
La placa dental es un biofilm bacteriano adherente. Es el agente etiológico principal de las enfermedades periodontales. Los datos disponibles muestran que los colutorios de clorhexidina y los de aceites esenciales tienen los mejores efectos antimicrobianos.
3. Marsh PD. Dental plaque as biofilm. J Industrial Microbiology 1995;15:169-75. [ Links ]
4. Marsh PD. Physiological approaches to the control of oral biofilms. Adv Dent Res 1997;11:176-85. [ Links ]
5. Costerton JW, Khoury AE, Ward KH, Anwar H. Practical measures to control device-related bacterial infections. Int J Artif Organs 1993;16:765-70. [ Links ]
6. Costerton JW. Biofilms, the customized microniche. J Bacteriology 1994;176:2137-42. [ Links ]
7. Costerton JW, Cheng KJ, Geesey GG, Ladd TI, Nickel JC, Dasgupta M et al. Bacterial biofilms in nature and disease. Annu Rev Microbiol 1987;41:435-64. [ Links ]
8*. Donlan, Costerton JW. Biofilms: Survival Mechanisms of Clinically Relevant Microorganisms. Clinical Microbiology Reviews 2002;167-93. [ Links ]
Artículo de lectura recomendable para saber en qué consisten los biofilms, cuál es su estructura, por qué presentan mayor resistencia frente a los antimicrobianos, enfermedades relacionadas con los mismos y cómo combatirlos.
Artículo de lectura recomendable para saber en qué consisten los biofilms, cuál es su estructura, por qué presentan mayor resistencia frente a los antimicrobianos, enfermedades relacionadas con los mismos y cómo combatirlos.
9**. Socransky SS, Haffajee AD. Biofilms dentales: objetivos terapeúticos difíciles. Periodontol 2000 2003;3:12-55. [ Links ]
Definición y características de los biofilms. Biofilms orales que conducen a enfermedades periodontales. Tratamiento de los biofilms periodontales.
Definición y características de los biofilms. Biofilms orales que conducen a enfermedades periodontales. Tratamiento de los biofilms periodontales.
10*. Quirynen M, Bollen CM. The influence of surface roughness and surface-free energy on supra- and subgingival plaque formation in man. A review of the literature. J Clin Periodontol 1995;22:1-14. [ Links ]
Factores que influyen en la formación de los biofilms.
Factores que influyen en la formación de los biofilms.
11. Sbordone L, Bortolaia C. Oral microbial biofilms and plaque-related diseases: microbial communities and their role in the shift from oral health to disease. Clin Oral Investig 2003;7:181-8. [ Links ]
12. Landa AS. Detachment of linking film bacteria from enamel surfaces by rinses and penetration of sodium lauryl sulphate through an artificial oral biofilm. Adv Dent Res 2004;11:528-38. [ Links ]
13. Baehni PC. Anti-plaque agents in the prevention of biofilm-associated oral diseases. Oral Diseases 2003; 9(suppl 1):23-9. [ Links ]
14. Xu KD. Biofilm resistance to antimicrobial agents. Microbiology 2000 2004; 146:547-9. [ Links ]
15. Marquis RE. Oxygen metabolism, oxidative stress and acid-base physiology of dental plaque biofilms. J Ind Microbiol 1995;15:198-207. [ Links ]
16. Fine DH, Furgang D, Barnett ML. Comparative antimicrobial activities of antiseptic mouthrinses against isogenic planktonic and biofilm forms of Actinobacillus actinomycetemcomitans. J Clin Periodontol 2001;28:697-700. [ Links ]
17. Chen C. Periodontitis as a biofilm infection. J Calif Dent Assoc 2001;29:362-9. [ Links ]
18. Darveau RP, Tanner A, Page RC. The microbial challenge in periodontitis. Periodontol 2000 1997;14:12-32. [ Links ]
19. Noiri Y, Ehara A, Kawahara T, Takemura N, Ebisu S. Participation of bacterial biofilms in refractory and chronic periapical periodontitis. J Endod 2002; 28:679-83. [ Links ]
20. Dahlen G. The effect of supragingival plaque control on the subgingival microbiota in subjects with periodontal desease. J Clin Periodontol 1992;19:802-9. [ Links ]
21. Barnett ML. The role of therapeutic antimicrobial mouthrinses in clinical practice: control of supragingival plaque and gingivitis. J Am Dent Assoc 2003;134:699-704. [ Links ]
22. Arweiler NB. Efficacy of an amine fluoridetriclosan mouthrinse as compared to the individual active ingredients. J Clin Periodontol 2003;30:192-6. [ Links ]
23**. Shapiro S. An in vitro oral biofilm model for comparing the efficacy of antimicrobial mouthrinses. Caries Res 2002; 36(2):93-100. Estudio in vitro sobre la capacidad de distintos colutorios para actuar sobre un modelo in vitro de un biofilm oral. [ Links ]
24. Arweiler NB. Alcohol-free mouthrinse solutions to reduce supragingival plaque regrowth and vitality. A controlled clinical study. J Clin Periodontol 2001;28:168-74. [ Links ]
25. Newman HN. The rationale for chemical adjuncts in plaque control. Int Dent J 1998;48:298-304. [ Links ]
26*. Herrera D, Roldán S, Santacruz I, Santos S, Masdevall M, Sanz M. Differences in antimicrobial activity of four commercial 0.12% chlorhexidine mouthrinse formulations: An in vitro contact test and salivary bacterial counts study. J Clin Periodontol 2003;30:307-14. [ Links ]
Estudio sobre la capacidad de distintas formulaciones de clorhexidina para actuar sobre las bacterias.
Estudio sobre la capacidad de distintas formulaciones de clorhexidina para actuar sobre las bacterias.
27*. Pan P. Determination of the in situ bactericidal activity of an essential oil mouthrinse using a vital stain method. J Clin Periodontol 2000;27:256-61. [ Links ]
Estudio sobre la capacidad de los aceites esenciales para penetrar en el biofilm y ejercer una acción antimicrobiana.
Estudio sobre la capacidad de los aceites esenciales para penetrar en el biofilm y ejercer una acción antimicrobiana.
28. Netuschil L. Plaque bacteria counts and vitality during chlorhexidine, meridol and listerine mouthrinses. Eur J Oral Science 2004;103:355-61. [ Links ]
29*. Ouhayoun JP. Penetrating the plaque biofilm: impact of essential oil mouthwash. J Clin Periodontol 2004; (suppl. 5):10-12. [ Links ]
Este artículo analiza la capacidad de los colutorios de aceites esenciales para penetrar en el biofilm y realizar una acción antimicrobiana.
Este artículo analiza la capacidad de los colutorios de aceites esenciales para penetrar en el biofilm y realizar una acción antimicrobiana.
30*. Council of Dental Therapeutics. Guidelines for acceptance of chemotherapeutic products for the control of supragingival dental plaque and gingivitis. J Am Dent Asso 1986;112:529-32. [ Links ]
Características de debe tener un estudio para poder validar un producto de uso en el hogar.
Características de debe tener un estudio para poder validar un producto de uso en el hogar.
Suscribirse a:
Entradas (Atom)

